
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 50. Практическая работа №7.
Решение экспериментальных задач по теме: “Металлы”
Вариант 1. Распознавание хлорида магния MgCl2, гидроксида натрия NaOH, карбоната натрия Na2CO3, нитрата натрия NaNO3 1. В четырёх пробирках даны следующие вещества в твёрдом виде: а) хлорид магния; 6) гидроксид натрия; в) карбонат натрия; г) нитрат натрия. При помощи химических реакций определите, в какой пробирке находится каждое из этих веществ.
|
Что делали? |
Что наблюдали? |
Вывод |
|
Твёрдые вещества растворили в воде, далее прилили соляную кислоту. |
В одной пробирке выделяется газ без цвета и запаха:
|
В пробирке — карбонат натрия. |
|
К другим растворам добавили несколько капель фенолфталеина. |
Содержимое одной из пробирок окрасилось с малиновый цвет. |
В пробирке — гидроксид натрия (образует щелочную среду). |
|
К оставшимся растворам добавили нитрат серебра. |
В одной пробирке выпадает белый осадок:
|
В одной пробирке находится хлорид магния, в пробирке с осадком — нитрат натрия. |
2. При помощи характерных реакций докажите, что выданное вам вещество — сульфат алюминия.

3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ.
|
Что делали? |
Что наблюдали? |
Вывод |
|
К растворам добавили сульфат калия. |
В одной пробирке выпадает белый осадок:
|
В пробирке — хлорид стронция. |
|
К оставшимся растворам прилили раствор гидроксида натрия. |
|
В пробирке — хлорид аллюминия. В пробирке с осадком — хлорид натрия. |
4. Практически осуществите следующие превращения:
Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe(NO3)3
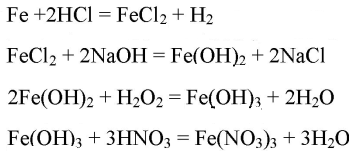
Вариант 2. Распознавание карбоната кальция CaCO3, нитрата стронция Sr(NO3)2, сульфата натрия NaSO4, сульфида натрия Na2S. 1. В четырех пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ.
|
Что делали? |
Что наблюдали? |
Вывод |
|
Растворили твёрдые вещества и добавили к растворам соляную кислоту. |
В пробирке вещество не растворилось в воде, после добавления соляной кислоты выделился газ без запаха и цвета:
|
В пробирке — карбонат кальция. |
|
В другой пробирке выделяется газ с характерным запахом тухлых яиц:
|
В пробирке — сульфид натрия. |
|
|
К остальным растворам прилили раствор серной кислоты. |
В одной из пробирок выпадает белый осадок:
|
В пробирке — нитрид стронция, в пробирке с осадком — сульфат натрия. |
2. Докажите, что кристаллы сульфата железа (III) частично окислились и содержат примеси ионов Fe3+.
Качественным реагентом на присутствие трёхвалентного железа является роданид калия. Появляется красное окрашивание.
![]()
3. В двух склянках дана вода. В одной из них вода содержит сульфат магния, а в другой — гидрокарбонат кальция. Проделайте опыты, при помощи которых можно устранить постоянную и временную жёсткость воды.
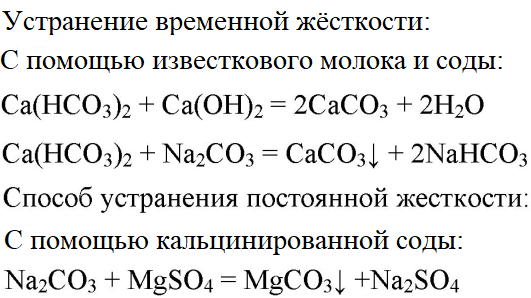
4. Практически осуществите следующие превращения:
Аl→Al2(SO4)3→Аl(ОН)3→Na[Al(OH)4]
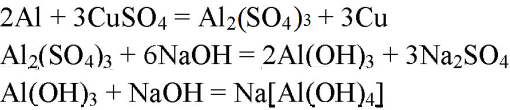
5. Отчёт о работе оформите в произвольной форме.
Отчёт представлен выше (1,2,3,4 пункты каждого варианта).
