
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 49. Соединения железа
Вопросы и задания
1. Составьте уравнения реакций, при помощи которых можно получить: а) соли железа(II) и соли железа(III); 6) гидроксид железа(II) и гидроксид железа(III); в) оксиды железа.

2. Какими общими и специфическими свойствами обладают оксиды и гидроксиды железа? Составьте уравнения соответствующих реакций.
Общие свойства оксидов и гидроксидов железа: способные к реакциям с кислотами:
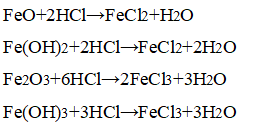
Специфические свойства: только оксиды и гидроксиды железа (III) способны реагировать с щёлочью, проявляя амфотерные свойства:
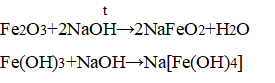
3. Определите, какое количество сероводорода (моль) образуется при взаимодействии сульфида железа(II) с соляной кислотой массой 130 г (массовая доля НС1 равна 20%).

4. Образец сидерита, основная часть которого FeCO3, содержит 40% железа. Вычислите, сколько процентов FeCO3 в этом образце.
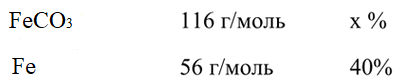
![]()
Ответ: 82,86 %
Тестовые задания
1. Расположите формулы оксидов в порядке усиления их основных свойств.
1) FeO
2) СаО
3) Na2O
4) Fe2O3
4) 1) 2) 3)
2. В схеме реакции Fe3O4 + … —> Fe + Н2O вместо многоточия следует поставить формулу
1) углерода
2) соли
3) водорода
4) оксида углерода(II)
3) водорода
3. Качественной реакцией на ионы Fe2+ и Fe3+ является их взаимодействие
1) с сульфат-ионами
2) с известковой водой
3) с кислотами
4) с гидроксид-ионами
4) с гидроксид-ионами
Выберите параграф
