
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 20. Оксид серы (IV). Сернистая кислота
Вопросы и задания
1. Составьте схему применения сернистого газа. Обсудите её с соседом по парте.
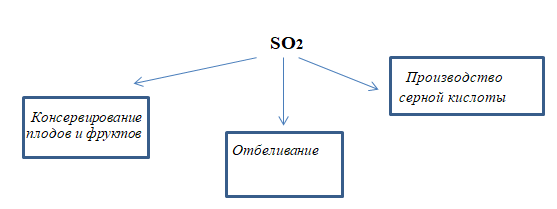
С помощью SO2 отбеливают материалы. которые нельзя отбелить хлором: солому, шерсть, шёлк. Ещё с помощью него окуривают овощехранилища и склады для уничтожения микроорганизмов.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
S→H2S→SO2→Na2SO3→BaSO3→SO2

3. Используя Интернет и дополнительную литературу, подготовьте презентацию из шести-семи слайдов на тему «Кислотные дожди».
При составлении презентации можно использовать следующую информацию:
Причины кислотных дождей:
Вследствие деятельности промышленных предприятий, выбросов ими больших объёмов оксидов серы и азота в атмосферу могут возникать метеорологические осадки, имеющие кислую среду. Самыми распространённые источники таких загрязнений являются выхлопные газы, выбрасываемые транспортом, металлургия и деятельность ТЭЦ. Современные средства очистки не в состоянии отфильтровать данные загрязнения, в результате такие загрязнения попадают в атмосферу и соединяются с водой в результате реакций под действием солнечного света, выпадают на землю в виде осадков — кислотных дождей.
Последствия кислотных дождей:
Такие осадки губительны для всех живых организмов. В частности они несут такие последствия:
- вымирание флоры и фауны водоёмов вследствие из закисления.
- угнетение лесов, растений, особенно хвойных деревьев.
- выход из строя механизмов, порча памятников архитектуры вследствии коррозии.
Что же делать?
Бороться с последствиями невозможно, следует направить силы на борьбу с причинами данного явления: поиск альтернативных источников энергии, использование экологичного транспорта, поиск новых источников производства и эффективных средств очистки выбросов в атмосферу. Человечество обязано работать над этим, чтобы в дальнейшем не допустить экологической катастрофы.
4. Определите объём сероводорода (н. у.), образовавшегося при реакции соляной кислоты с 2 кг сульфида железа(II), содержащего 10 % примесей.

Тестовые задания
1. Для получения оксида серы(IV) невозможно использовать химическую реакцию
1) S + О2→
2) H2S + O2→
3) ВаСО3→
4) Na2SO3 + НСl→
3) ВаСО3→
2. В техническом хлориде натрия содержится примесь сульфита натрия. Обнаружить эту примесь можно с помощью раствора
1) гидроксида калия
2) сульфида калия
3) серной кислоты
4) карбоната калия
3) серной кислоты
