
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 37. Кремний. Оксид кремния (IV)
Вопросы и задания
1. Работая в парах, составьте характеристику кремния по плану: нахождение в природе→получение→состав→строение→свойства→применение.
Нахождение в природе:
Кремний занимает второе место по распространённости в природе после кислорода. В основном встречается в виде кремнезема SiO2. Песок (речной и кварцевый), кварц и кварциты, кремень, полевые шпаты — образованы диоксидом кремния. силикаты и алюмосиликаты — вторая по распростанённости группа кремниевых соединений.
Получение:
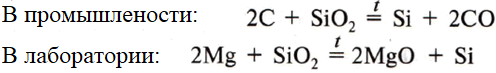
Состав:
Молекула состоит из одного атома кремния.
Строение:
Атомная кристаллическая решётка.
Свойства:
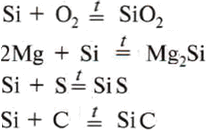
Применение:
В металлургии, приборостроении, электрохимии.
2. В чём сходство и различия высших оксидов углерода и кремния?
Различия:
|
СO2 |
SiO2 |
|
Газ |
Твёрдое вещество |
|
Кристаллическая решётка: молекулярная |
Кристаллическая решётка: атомная |
|
Температура плавления: -56,6С |
Температура плавления: +1728С |
|
Взаимодействует с водой с образованием слабой угольной кислоты. |
Не взаимодействует с водой. |
Сходства:
СO2 и SiO2 — оксиды в высшей степени окисления — сильные восстановители.
СO2 и SiO2 — кислотные оксиды, взаимодействуют с основными оксидами, основаниями и солями более слабых кислот.
3. Напишите уравнения реакций, соответствующих следующим превращениям:
SiO2→Si→Mg2Si→SiH4→SiO2
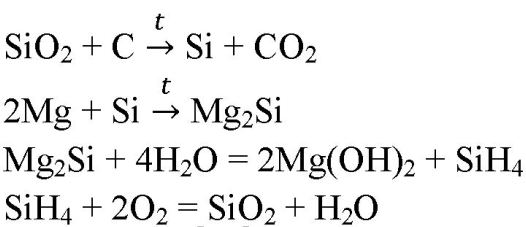
Тестовые задания
1. Для оксида кремния(IV) характерны следующие физические свойства:
1) газ, без запаха
2) твёрдое вещество жёлтого цвета
3) жидкость, легче воды
4) кристаллическое вещество, не растворяющееся в воде
4) кристаллическое вещество, не растворяющееся в воде
2. Оксид кремния(IV) вступает в реакцию:
1) с кислородом
2) с водой
3) с щелочью
4) с кислотой
3) с щелочью
