
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 1. Окислительно-восстановительные реакции
Вопросы и задания
1. Определите степени окисления элементов в следующих соединениях: Li2O, Na2O2, H2S, LiH, P2O5, K2Cr2O7.

2. Докажите, что реакция 2Fe + 3Cl2 = 2FeCl3 является окислительно восстановительной. Укажите окислитель и восстановитель.
Данная реакция окислительно-восстановительная, так как во время её протекания элементы изменяют свою степень окисления.
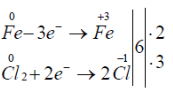
Fe — восстановитель; Cl — окислитель.
3. Заполните таблицу, приведя по два примера реакций соединения и разложения, которые не являются окислительно-восстановительными. Обсудите таблицу с соседом по парте. Проверьте друг у друга заполненную таблицу.
|
Тип реакции |
Примеры реакций, протекающих без изменения степени окисления элементов |
|
Реакции соединения |
K2O+CO2→K2CO3 H2O+SO3→H2SO4 |
|
Реакции разложения |
t CaCO3→CaO+CO2 Cu(OH)2→CuO+H2O |
4. Даны схемы реакций:
а) Zn + Сl2→ZnCl2
б) Zn + НСl→ZnCl2 + H2f
Проставьте над знаками соответствующих химических элементов степени окисления, покажите переход электронов и расставьте коэффициенты.
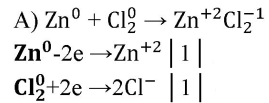
Zn — восстановитель, Cl — окислитель.
Zn + Cl2→ZnCl2
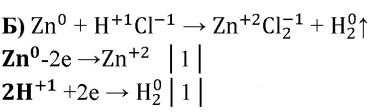
Zn — восстановитель, H — окислитель.
Zn +2HCl→ZnCl2+H2↑
5. Даны схемы окислительно-восстановительных реакций:
а) CuS + HNO3(paзб.) — Cu(NO3)2 + S + NO + H2O
б) K2SO3 + H2SO4 + KMnO4 — K2SO4 + MnSO4 + …
Составьте уравнения этих реакций, пользуясь алгоритмом, приведённым в параграфе.
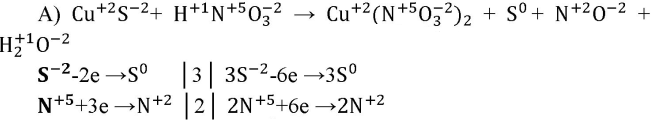
S — восстановитель, N — окислитель.
![]()
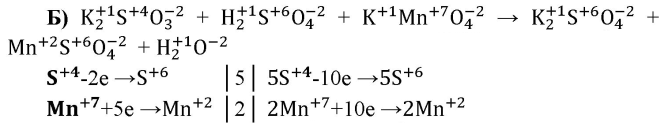
S — восстановитель, Mn — окислитель.
![]()
6. В схеме реакции HNO3→H2O + NO2 + O2 расставьте коэффициенты методом электронного баланса.
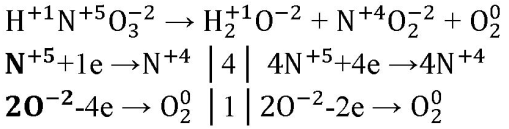
O — восстановитель, N — окислитель.
![]()
Тестовые задания
1. К окислительно-восстановительным реакциям не относится реакция:
1) CU+HNO3→CU(HNO3)2+H2O+NO2
2) CUO+P2O5→CU3(PO4)2
3) CUO+H2→CU+H2O+SO2
4) CU+H2SO4→CUSO4+H2O+SO2
2) CUO+P2O5→CU3(PO4)2
2. Установите соответствие между окислительно-восстановительным процессом, обозначенным схемой передачи электронов, и схемой химической реакции.
- Б.
- Д.
- А.
- Г.
