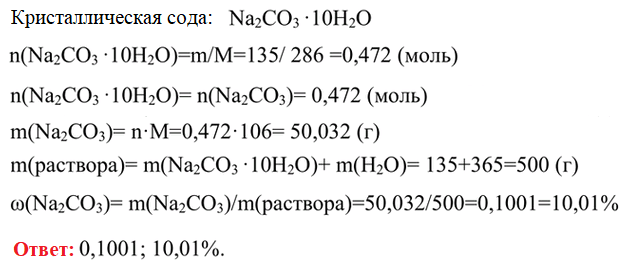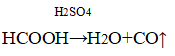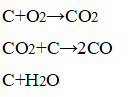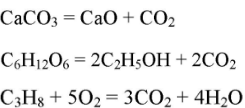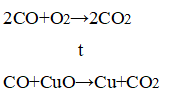Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 34. Оксид углерода (IV) — углекислый газ
Вопросы и задания
1. Составьте уравнения реакций, протекающих с образованием оксида углерода (IV) в природе, в быту, в лаборатории и в промышленности.
В природе (дыхание, брожение, гниение):
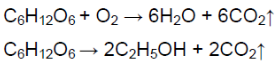
В быту (сгорание природного газа):
![]()
В лаборатории (реакция кислот с мелом и мрамором):
![]()
В промышленности (спиртовое брожение глюкозы, разложение известянка, сгорание углеродосодержащих веществ):
![]()
![]()
![]()
2. Работая в парах, расскажите друг другу об оксидах углерода, характеризуя их по плану: состав→строение→получение→свойства→применение.
|
CO |
CO2 |
|
|
Состав |
Молекула состоит из одного атома углерода и одного атома кислорода |
Молекула состоит из одного атома углерода и двух атомов кислорода |
|
Строение |
Третья ковалентная связь образуется по донорско-акцепторному принципу: кислород — донор электронной пары, углерод — акцептор. |
Связи ковалентно-полярные образованные за счёт взаимодействия одного электрона из каждой пары. Линейное строение. |
|
Получение |
В лаборатории:
В промышленности:
|
В лаборатории:
В промышленности:
|
|
Свойства |
СO — сильный восстановитель:
|
CO2 реагирует с водой:
с основными оксидами:
реагирует с основаниями:
|
|
Применение |
Применяется как газообразное топливо, а также в органическом синтезе. |
Применяется в пищевой промышленности как разрыхлитель и консервант, для газированной воды (газирование). “Сухой лёд”, средства бытовой химии, в пожаротушении. |
3. Какой объём углекислого газа (н. у.) выделится при обжиге 500 известняка, содержащего 0,1 массовой доли примесей?

4. В 365 г воды растворили 135 г кристаллической соды. Определите массовую долю (в долях единицы и в процентах) безводной соли (Na2CO3) в полученном растворе.