
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 46. Алюминий
Вопросы и задания
1. Пользуясь периодической таблицей и на основе представлений о строении атомов, поясните, как изменяются свойства элементов в ряду Na — Mg — Al.
От Na через Mg до Al относительные массы возрастают и постепенно ослабляются металлические (восстановительные) и усиливаются неметаллические (окислительные) свойства. Это происходит из-за увеличения количества электронов на внешнем энергетическом уровне и уменьшения радиуса. Чем количество электронов меньше и больше радиус (Na), тем сильнее проявляются восстановительные свойства.
2. Почему алюминий в природе встречается только в соединениях?
В электрохимическом ряду напряжений алюминий находится за самыми активными металлами. Он легко вступает в реакции с другими веществами и в природе встречается в составе разнообразных соединений.
3. Охарактеризуйте важнейшие природные соединения алюминия.
Каолинит
![]()
Боксит
![]()
Корунд
![]()
Ортоклаз или полевой шпат
![]()
Нефелин
![]()
4. Для получения алюминия из АlСl3 в качестве восстановителя можно использовать кальций. Охарактеризуйте этот процесс и составьте уравнение реакции, покажите переход электронов. Почему эту реакцию нельзя проводить в водном растворе?
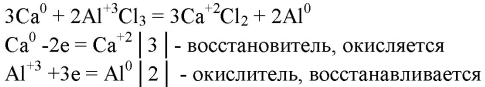
Реакцию проводят в расплаве, а не в водном растворе, потому что кальций вступит в реакцию с водой:
![]()
5. Составьте уравнения реакций, в которых алюминий восстанавливает: а) галогены; б) железо; в) ионы водорода; г) серу; д) кислород. Покажите переход электронов.
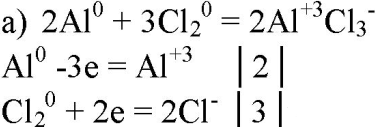
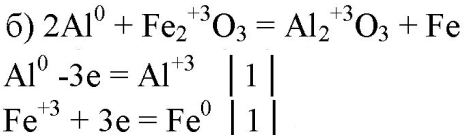
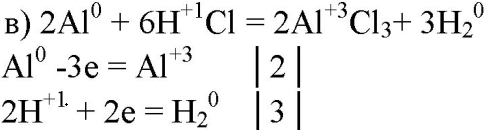
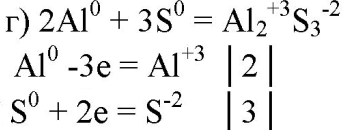
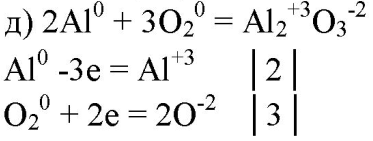
6. Могут ли быть окислителями: а) атомы алюминия; б) ионы алюминия? Ответ подтвердите уравнениями реакций.
а) Атомы алюминия не могут быть окислителями, потому что металлы не имеют способности принимать электроны.
б) Ионы алюминия могут быть окислителями
![]()
7. Сколько потребуется алюминия, чтобы при реакции с соляной кислотой получить столько водорода, сколько его выделяется при взаимодействии 1 моль натрия с водой?

8. На сплав алюминия и меди подействовали избытком концентрированного раствора гидроксида натрия при нагревании. Выделилось 2,24 л некоторого газа (н. у.). Вычислите процентный состав сплава, если его общая масса была 10 г.

Тестовые задания
1. Схема строения иона Аl — это:
- 2,8
2. Один из способов получения металлов, например, по уравнению реакции
Fe2O3 + 2Аl = Аl2O3 + 2Fe называют:
Алюмотермией
3. Химическую реакцию, уравнение которой 2Аl + 6НСl→2АlСl3 + ЗН2↑, относят к реакциям:
1) соединения
2) разложения
3) обмена
4) замещения
4) замещения
4. Установите соответствие между названием минерала и его формулой.
1) боксит
2) корунд
3) каолинит
4) полевой шпат
А. Аl2O3
Б. К2O • Аl2O3 • 6SiO2
В. Аl2O3 • 2SiO2 • 2Н2O
Г. Аl2O3 • nН2O
- Г
- А
- В
- Б
