
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 13. Хлор
Вопросы и задания
1. В виде каких соединений хлор встречается в природе? Назовите наиболее важные из них и покажите их месторождения на карте. Почему хлор в природе не встречается в свободном состоянии? Оцените выполнение этого задания у соседа по парте.
Из-за высокой активности хлор в природе встречается только в виде соединений в составе минералов: галита NaCl (Северная Америка), сильвина KCl (Германия, Великобритания, Канада, США, Индия, Италия, Россия, Белоруссия), сильвинита KCL•NaCl (Канада, Россия, Белоруссия, Израиль, Узбекистан, Германия), бишофита MgCL2•6H2O (Германия, Россия, Украина), карналлита KCl•MgCl2•6H2O, каинита KCl•MgSO4•3H2O.
2. Охарактеризуйте основные химические свойства хлора. Составьте уравнения химических реакций: а) лития с хлором; б) сгорания порошка железа в хлоре; в) горения водорода в хлоре; г) взаимодействия хлора с водой. Над знаками химических элементов проставьте степени окисления. Укажите окислитель и восстановитель.

3. Почему синяя лакмусовая бумага в свежеприготовленной хлорной воде обесцвечивается, а в хлорной воде, которая длительное время находилась на свету, краснеет?
Постепенно образовывается соляная кислота, которая создаёт кислую среду раствора и окрашивает лакмус в красный цвет. В свежеприготовленном растворе хлор не успевает среагировать, потому что вода является нейтральной средой, лакмус обесцвечивается.
4. На каких химических свойствах хлора основано его использование на практике? Напишите уравнения соответствующих реакций.
1.В хозяйственной деятельности: отбеливание тканей, очищение питьевой воды:
![]()
При взаимодействии хлора с водой образуется хлорноватистая кислота (сильный окислитель). Она разлагается, образуя кислород, обеспечивающий отбеливание.
![]()
2.Хлорирование (Получение пластмасс, медикаментов, красителей путём присоединения атомов хлора к органическим соединениям).
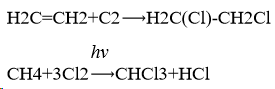
3.Производство соляной кислоты:
![]()
5. В закрытом прочном сосуде смешали 8 л хлора с 12 л водорода (н. у.) и смесь взорвали. Какой объём хлороводорода получился? Какой газ и в каком объёме остался в избытке?

6. Рассчитайте объем (н. у.), массу и количество вещества хлора, выделившеюся при взаимодействии оксида марганца(IV) МnO2 массой 17,4 г с соляной кислотой, взятой в избытке.

7. Рассмотрите рисунок 11. Используя Интернет или дополнительную литературу, узнайте, какое применение находят хлориды свинца и титана.
Хлорид титана (IV) TiCl4 применяется для:
- Как дымообразователь, для получения титана, оксида TiO2, катализаторов.
- Производства пигментной двуокиси титана, губчатого титана.
Хлорид свинца (II) PbCl2 применяется:
- Как катализатор в химической промышленности.
- Как катодный материал в резервных источниках тока.
Тестовые задания
1. Реакция окисления железа хлором относится к реакциям
1) замещения
2) разложения
3) соединения
4) обмена
3) соединения
2. Степень окисления хлора в хлорной кислоте НСlO4 равна
1) 0
2) -1
3) +7
4) +1
3) +7
3. Определите вещество по описанию: газ жёлто-зелёного цвета с резким удушливым запахом, почти в 2,5 раза тяжелее воздуха.
1) кислород
2) хлор
3) водород
4) аргон
2) хлор
