
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 18. Свойства и применения серы
Вопросы и задания
1. Объясните, в каких случаях сера может проявлять свойства окислителя, а в каких — восстановителя. Приведите примеры.
С углеродом, водородом и металлами сера проявляет окислительные свойства:
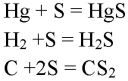
Сера проявляет восстановительные свойства с более электроотрицательными элементами:
![]()
2. Составьте уравнения реакций, при которых из простых веществ образуются сложные вещества: Li2S, ZnS, SO2, SF6. Поясните, какие свойства (окислительные или восстановительные) проявляет сера в этих реакциях.

3. При образовании из простых веществ 1 моль оксида cepы (IV) выделяется теплота в количестве 332,8 кДж. Сколько выделится теплоты при сгорании 1 г серы?
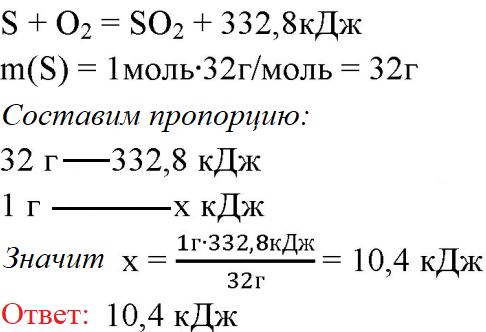
Тестовые задания
1. Установите соответствие между приведённой схемой химической реакции и примером, иллюстрирующим её.
A. 2H2S + 3O2 = 2SO2 + 2Н2O
Б. Н2 + S = H2S
B. 2SO2 + О2 = 2SO3
Г. S + O2 = SO2
Д. 2H2S + SO2 = 3S + 2Н2O
1. Б
2. В
3. Г
2. Бинарные соединения серы с металлами называют
1) сульфатами
2) сульфитами
3) сульфидами
4) сернистыми металлами
3) сульфидами
Выберите параграф
