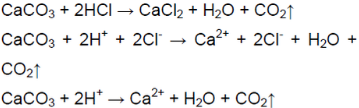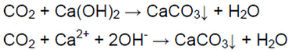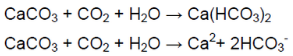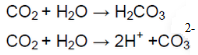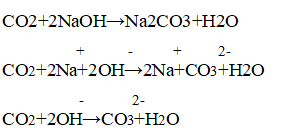Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 36. Практическая работа №6.
Получение оксида углерода (IV). Распознавание карбонатов
1. Получение оксида углерода(IV) и изучение его свойств. 1) Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Пробирку быстро закройте пробкой с газоотводной трубкой. Конец трубки поместите в другую пробирку, в которой находится 2—3 мл известковой воды. Несколько минут пропускайте выделяющийся газ через известковую воду. Что происходит, если на мел (мрамор) действуют соляной кислотой? Почему при пропускании образующегося газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется? 2) Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Поместите трубку в пробирку с 2—3 мл дистиллированной воды и пропустите через нес выделяющийся газ. Через несколько минут выньте трубку из раствора и добавьте к нему несколько капель синего лакмуса. Что наблюдаете? 3) В пробирку налейте 2—3 мл разбавленного раствора гидроксида натрия, добавьте к нему несколько капель фенолфталеина и затем через раствор пропустите выделяющийся газ. Что наблюдаете? Напишите уравнения всех проведённых реакций в молекулярном, ионном и сокращённом ионном виде.
|
Что делали? |
Что наблюдали? |
Вывод |
|
Поместили в пробирку несколько кусочков мела и прилили немного разбавленной соляной кислоты. Пробирку быстро закрыли пробкой с газоотводной трубкой. Конец трубки поместили в другую пробирку, в которой находится 2—3 мл известковой воды. |
В результате реакции соляной кислоты с мелом выделяется углекислый газ:
Когда пропускали газ через известковую воду, она сначала мутнеет — выпадает осадок — карбонат кальция:
В ситуации избытка газа взвесь растворяется (карбонат превращается в гидрокарбонат, растворимый в воде):
|
Углекислый газ можно получить путём воздействия сильной кислоты на карбонат. Для его распознавания применяется известковая вода (при недостатке карбоната она мутнеет, при его избытке осадок растворяется). |
|
Конец газоотводной трубки вынули из раствора и сполоснули в дистиллированной воде. Поместили трубку в пробирку с 2—3 мл дистиллированной воды и пропустили через нес выделяющийся газ. Через несколько минут вынули трубку из раствора и добавили к нему несколько капель синего лакмуса. |
Раствор лакмуса окрасился в красный цвет, что говорит об образовании кислотной среды, которую обеспечивает угольная кислота:
|
Угольная кислота образуется при растворении углекислого газа в воде. Угольная кислота диссоциирует на ионы водорода, окрашивающие лакмус в красный цвет. |
|
В пробирку налили 2—3 мл разбавленного раствора гидроксида натрия, добавили к нему несколько капель фенолфталеина и затем через раствор пропустили выделяющийся газ. |
Раствор фенолфталеина, который окрасился в малиновый цвет при взаимодействии с гидроксидом натрия, поменял цвет на бледно розовый (образовалась соль, состоящая из катионов сильной щелочи и анионов слабой кислоты).
|
Углекислый газ реагирует с щелочами, образуя соль, которая при гидролизе образует слабощелочную среду. |
2. Распознавание карбонатов. В трех пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите, какое вещество находится в каждой пробирке. Сделайте вывод, что является качественной реакцией на карбонат-ионы. Напишите соответствующее уравнение реакции.
|
Что делали? |
Что наблюдали? |
Вывод |
|
К трём растворам добавили соляную кислоту |
В двух пробирках реакция не идёт |
С соляной кислотой не взаимодействуют сульфат натрия и хлорид цинка, в этих пробирках находятся эти вещества. |
|
Выделяется газ без цвета и запаха |
В пробирке карбонат калия:
Качественная реакция на карбонат-ионы — взаимодействие с сильной кислотой с выделением газа без цвета и запаха. |
|
|
Добавили к раствору нитрат серебра (I) |
В одной пробирке выпадает осадок белого цвета. |
В пробирке находится хлорид цинка.
Белый осадок означает, что соль + является хлоридом (ионы Ag — связываются с ионами Сl). В пробирке, в которой не произошло изменений, находится сульфат натрия. |
3. Отчёт о работе оформите в виде таблицы (см. § 16).
Таблица представлена выше (пункты 1,2).