
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 12. Характеристика галогенов
Вопросы и задания
1. Начертите схемы распределения электронов по энергетическим уровням в атомах галогенов. Поясните, какой из галогенов и почему должен быть самым сильным окислителем.
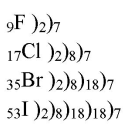
Самым сильным окислителем является фтор, потому что его атом легче всего присоединяет недостающий из-за наименьшего радиуса атома.
2. Изобразите строение молекул фтора и фтороводорода с помощью структурных и электронных формул. Укажите вид химической связи в молекулах этих веществ.

3. Чем различаются вещества фтор, фтороводород, фторид натрия: а) по виду химической связи; б) по строению кристаллической решётки; в) по химическим свойствам?
|
а) |
б) |
в) |
|
|
Фтор F2 |
Ковалентная неполярная связь |
Молекулярная кристаллическая решётка |
Самый сильный окислитель из простых веществ. Взаимодействует почти со всеми веществами |
|
Фтороводород HF |
Ковалентная полярная связь |
Молекулярная кристаллическая решётка |
Средний окислитель. реагирует с активными металлами, основными и амфотерными оксидами, основаниями. |
|
Фторид натрия NaF |
Ионная связь |
Ионная кристаллическая решётка |
Средняя соль. Реагирует с сильными кислотами, солями. в результате взаимодействия выпадает осадок. |
4. Охарактеризуйте способы получения галогенов. Какие из галогенов труднее, а какие легче выделить в свободном состоянии?
В промышленности: пропуск электрического тока через расплавы и растворы соответствующего электролита.
В лаборатории: применение окислителя или способом вытеснения более активными галогенами менее активных.
Фтор — сильнейший окислитель, поэтому его труднее всего выделить в свободном состоянии, а, например, йод — легче всего.
5. К водному раствору иодида калия добавили раствор крахмального клейстера. Затем через этот раствор пропустили хлор. Как изменился цвет раствора и почему?
![]()
В результате реакции выделяется йод, в соединении с крахмалом он окрасится в синий цвет.
Тестовые задания
1. Наиболее сильным окислителем является галоген
1) фтор
2) хлор
3) бром
4) иод
1) фтор
2. Нельзя практически осуществить химическую реакцию
1) KI + Вr2
2) KI + Сl2
3) КСl + Вr2
4) F2 + Н2O
3) КСl + Вr2
