
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 19. Сероводород. Сульфиды
Вопросы и задания
1. Составьте уравнения окислительно-восстановительных реакций полного и неполного сгорания сероводорода. Укажите окислитель и восстановитель.

2. Запишите уравнение химической реакции сероводорода с раствором нитрата свинца(II) в молекулярном, полном и сокращённом ионном виде. Отметьте признаки этой реакции.
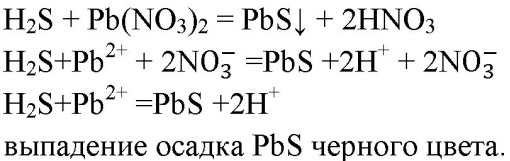
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CuS→H2S→SO2→SO3
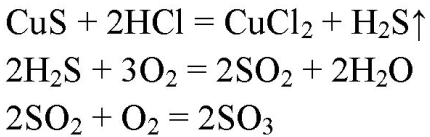
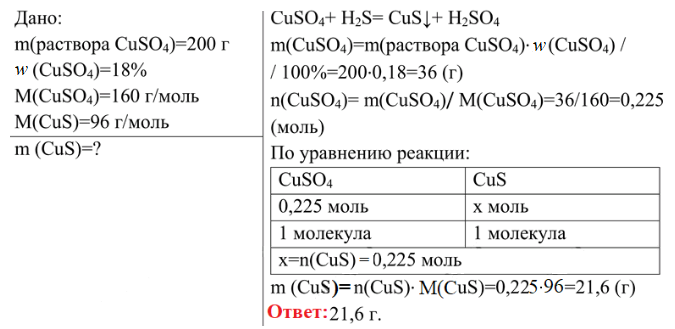
4. Сероводород пропустили через 200 г раствора сульфата меди(II) (массовая доля CuSO4 равна 18%). Вычислите массу осадка, выпавшего в результате этой реакции.
Тестовые задания
1. Летучие водородные соединения элементов VIA-группы имеют кристаллическую решётку
1) ионную
2) атомную
3) молекулярную
4) металлическую
3) молекулярную
2. Сероводород проявляет свойства восстановителя в химических реакциях
1) H2S + О2→S + H2O
2) H2S + NaOH→Na2S + Н2O
3) H2S + SO2→S + H2O
4) H2S + Pb(NO3)2→PbS + HNO3
5) H2S + O2→SO2 + H2O
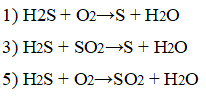
Выберите параграф
