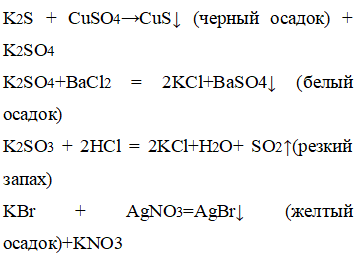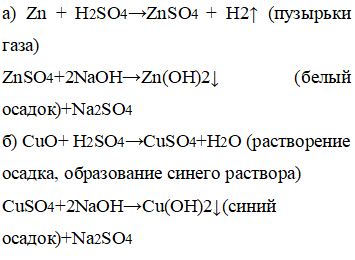Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 22. Практическая работа №4
Решение экспериментальных задач по теме “Кислород и сера”
1. Даны пробирки с растворами: а) сульфата натрия; б) хлорида натрия; в) серной кислоты. Опытным путём определите, в какой пробирке находится каждое из указанных веществ.
|
Что делали? |
Что наблюдали? |
Вывод |
|
Поместили лакмус и нитрат серебра в три пробирки с растворами |
В пробирке, где находилась серная кислота, лакмус окрасился в красный цвет. в пробирке. где находился хлорид натрия, после добавления нитрата серебра выпал белый осадок. |
Серная кислота при взаимодействии с лакмусом окрашивает его в красный цвет (кислота закисляет среду, остальные две соли образованы сильными основаниями и сильными кислотами→не гидролизируются и дают нейтральную среду→лакмус не меняет цвет.) Качественная реакция на хлориды — выпадение белого осадка хлорида серебра:
В пробирке. где лакмус не поменял цвет. находится сульфат натрия. |
2. Дан раствор сульфата меди (II). Получите из него раствор хлорида меди(II).
|
Что делали? |
Что наблюдали? |
Вывод |
|
Поместили к раствору сульфата меди раствор хлорида бария. |
Сульфат бария выпадает в осадок. |
Качественной реакцией а сульфаты является выпадение осадка сульфата бария. Одновременно таким способом можно получить и хлорид меди:
|
3. Даны четыре пронумерованные пробирки, в которых находятся следующие соли калия: сульфид, сульфат, сульфит, бромид. Определите при помощи характерных реакций каждое из данных веществ.
|
Что делали? |
Что наблюдали? |
Вывод |
|
Добавили к сульфиду калия сульфат меди, к сульфату калия добавили хлорид бария, к сульфиту калия – соляную кислоту, к бромату калия – нитрат серебра. |
В пробирке с сульфидом калия выпал черный осадок, с сульфатом калия – белый осадок, с бромидом калия – желтый осадок, с сульфитом калия – появился резкий запах. |
С помощью качественных реакции можно определить каждый представленный анион:
|
4. Проделайте опыты но осуществлению следующих превращений:
а) цинк→сульфат цинка→гидроксид цинка
б) оксид меди(II)→сульфат меди(II)→гидроксид меди(II)
|
Что делали? |
Что наблюдали? |
Вывод |
|
а) К цинку добавили серную кислоту, а далее гидроксид натрия. б) К оксиду меди добавили серную кислоту, а далее гидроксид натрия. |
а) Вследствие добавления кислоты образовались пузырьки газа, вследствие добавления щелочи образовался белый осадок. б) Вследствие добавления кислоты образовался синий раствор, вследствие добавления щелочи образовался синий осадок. |
|
5. Даны вещества: серная кислота, цинк, растворы нитрата стронция, хлорида натрия, хлорида кальция, хлорида меди(II). Проверьте опытным путём, с какими веществами реагирует серная кислота. Почему? Какие реакции относятся к окислительно-восстановительным? Ответ мотивируйте.
|
Что делали? |
Что наблюдали? |
Вывод |
|
Добавили к цинку, нитрату стронция, хлориду натрия, хлориду кальция и хлориду меди серную кислоту. |
При взаимодействии серной кислоты с цинком образовались пузырьки газа (окислитель-восстановительная реакция — цинк и водород изменяют свои степени окисления), с нитратом стронция — выпал белый осадок, с хлоридами натрия и меди — реакции нет. |
Реакция с серной кислотой идёт с металлами, стоящими в электрохимическом ряду до водорода, с солями, если в результате реакции выпадает осадок и вытесняет летучие кислоты из солей. |
6. Проделайте реакции, подтверждающие качественный состав серной и соляной кислот.
|
Что делали? |
Что наблюдали? |
Вывод |
|
Добавили к соляной и серной кислоте лакмус; поместили к соляной кислоте нитрат серебра, к серной кислоте добавили хлорид бария. |
Лакмус окрасился в красный цвет; после добавления реагентов выпали белые осадки. Тот факт, что лакмус окрасился в красный, говорит о том, что в составе веществ присутствует H+. |
Появление осадка хлорида серебра говорит о наличии в составе соляной кислоты хлорид-аниона:
Появление осадка сульфата бария говорит о наличии в составе серной кислоты сульфат-аниона:
|