
Автор: Габриелян О.С.
Издательство: Дрофа
Тип: Учебник
Практическая работа №9
Решение экспериментальных задач
1.Цинк растворяется в концентрированной кислоте с выделением газа. Влажная универсальная индикаторная бумажка у горлышка пробирки краснеет — этот газ не водород.

Вывод: в данной реакции выделяется сернистый газ; окислителем является сера.

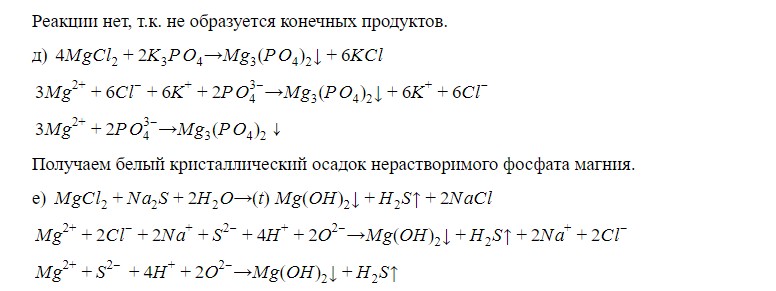
Получаем белый осадок нерастворимого гидроксида магния с выделением сероводорода с характерным запахом “тухлых яиц”
Вывод: реакции между данными веществами идут только в случае получения осадка или выделения газа; полученный гидроксид и нерастворимые соли магния- белого цвета.
3. Даны растворы: а) карбоната калия и соляной кислоты; б) сульфида натрия и серной кислоты; в) хлорида цинка и азотной кислоты; г) сульфита натрия и серной кислоты; д) сульфата меди (II) и азотной кислоты.
Слейте попарно эти растворы, слегка нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Напишите уравнения в молекулярном и ионном виде.
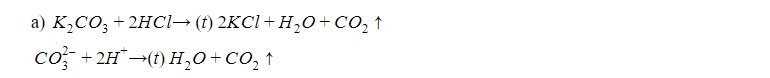
Реакция идет с выделением газа без цвета и запаха. Когда подносим горящую лучинку к горлышку пробирки, лучинка гаснет. Это- углекислый газ.
![]()
Реакция идет с выделением газа с характерным запахом “тухлых яиц”.
Это — сероводород.
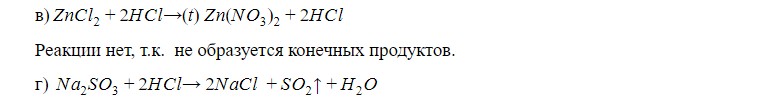
Реакция идет с выделением газа с характерным запахом “сгоревших спичек”.
Это — сернистый газ.
![]()
Реакции нет, т.к. не образуется конечных продуктов
Вывод: реакции между данными веществами идут только в случае выделения газа.

Реакция идет с небольшим подогревом.
Выделяется газ без цвета и запаха. Когда подносим горящую лучинку к горлышку пробирки, лучинка гаснет.
Это — углекислый газ.
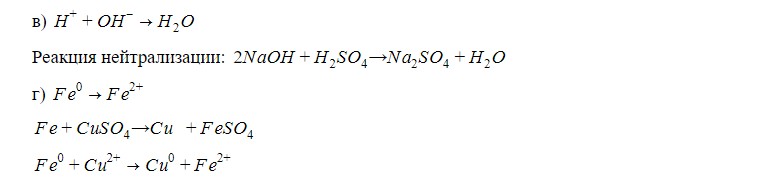
Железо выталкивает медь из сульфата, т.к. является более активным металлом; происходит реакция замещения, чистая медь оседает на железной пластинке.



Алюминий растворяется, выделяется газ. Если поднести лучинку к пробирке, слышен хлопок- микровзрыв водорода и кислорода.
Газ — водород.

Алюминий- восстановитель, водород- окислитель.
г) Медь растворяется в концентрированной кислоте, раствор становится голубым, выделяется газ. Влажная универсальная индикаторная бумажка у горлышка пробирки краснеет- этот газ не водород.

Медь- восстановитель, сера- окислитель.
6. Пользуясь растворами и веществами, получите вещества. Составьте молекулярные и ионные уравнения.
а) гидроксид железа (III)
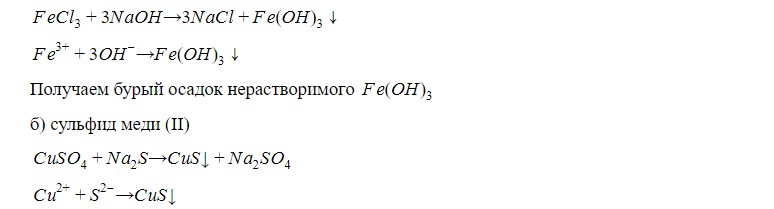
Получаем черный с “теплым” оттенком осадок сульфида меди (II).
в) оксид серы (IV)
Медь растворяется в концентрированной кислоте, раствор становится голубым, выделяется газ. Влажная универсальная индикаторная бумажка у горлышка пробирки краснеет- этот газ не водород.

Получаем плотный белый осадок нерастворимого карбоната магния в виде суспензии.
д) свинец
ЭТАП 1. Термическое разложение нитрата свинца (II)

В центральный шар насыпаем гранулы цинка. Сверху через воронку наливаем раствор соляной кислоты. Открываем кран, соляная кислоты заполняет нижнее полушарие, поднимается к центральному; и реакция начинается:
![]()
Собираем водород в перевернутую вверх дном пробирку (методом вытеснения воздуха).
Проверка на чистоту — пронести пробирку над спиртовкой. Если водород чистый, раздается характерный хлопок микровзрыва.
ЭТАП 3. Получение чистого свинца

