
Автор: Габриелян О.С.
Издательство: Дрофа
Тип: Учебник
Практическая работа №8
Свойства кислот, оснований, оксидов и солей
Задание 1
Вариант 1
Химические свойства соляной кислоты
1. Реакция с активным металлом с выделением водорода

2. Реакция с оксидом металла
Оксид меди (I)- порошок черного цвета, нерастворимый в воде. Если прилить раствор соляной кислоты и подогреть, нерастворимый черный осадок исчезает, раствор становится бирюзовым.

Получаем раствор хлорида меди (I) в воде.
3. Реакция с щелочью (нейтрализации)

4. Реакция с нерастворимым основанием

Нерастворимый осадок гидроксида железа (II) бурого цвета превращается в прозрачный желтый раствор растворимого хлорида железа (III).
5. Реакция с солью

Вариант 2
Химические свойства серной кислоты
1. Реакция с активным металлом с выделением водорода

2. Реакция с оксидом металла
Оксид меди (II)- порошок черного цвета, нерастворимый в воде. Если прилить раствор серной кислоты и подогреть, нерастворимый черный осадок исчезает, раствор становится голубым.

Получаем раствор сульфида меди (II) в воде.
3. Реакция с щелочью (нейтрализация)

4. Реакция с нерастворимым основанием

Нерастворимый осадок гидроксида железа (II) зелено-бурого цвета превращается в прозрачный светло-желтый раствор растворимого сульфата железа (II).
5. Реакция с солью

Задание 2
Вариант 1
Химические свойства раствора гидроксида натрия
1. Реакция с кислотой (нейтрализация)

2. Реакция с кислотным оксидом
Углекислый газ- выдох через соломинку.

3. Реакция с солью

Полученный осадок гидроксида меди (II)- темно-голубого цвета, нерастворим в воде, образует суспензию.
Вариант 2
Получение и химические свойства гидроксида железа (III)


Нерастворимый осадок гидроксида железа (III) бурого цвета превращается в прозрачный желтый раствор растворимого хлорида железа (III).
2. Реакция разложения
![]()
После выпаривания получаем оксид железа (III) красно-коричневого цвета.
Задание 3
Вариант 1
Получение и химические свойства сернистого газа.

Закроем пробирку пробкой с газоотводной трубкой.
Будем нагревать пробирку каждый раз, когда нужно получить выход газа, а газоотводную трубку направлять в пробирку с реактивами для исследований.


После выпаривания получаем кристаллы белого цвета- кристаллогидрат сульфита кальция.
Используется в пищевой промышленности (добавка E226).
4. Реакция с галогенами
Образует кислоты:
![]()
Синяя лакмусовая бумажка краснеет.
Вариант 2
Химические свойства оксида кальция
1. Реакция с водой
Протекает бурно, с парообразованием

Раствор становится малиновым- реакция на щелочную среду.
2. Реакция с кислотным оксидом
![]()
После выпаривания получаем кристаллы белого цвета- кристаллогидрат сульфита кальция.
Используется в пищевой промышленности (добавка E226).
3. Реакция с кислотой

Задание 4
Вариант 1
Химические свойства хлорида железа (II)
1. Реакция с кислотой
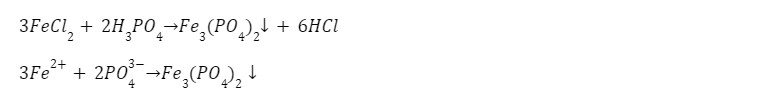
выпадает осадок фосфата железа (II) белого цвета.
2. Реакция с щелочью

Выпадает зелено-бурый осадок нерастворимого гидроксида железа (II).
3. Реакция с солью

Выпадает белый осадок нерастворимого хлорида серебра.
4. Реакция замещения с металлом
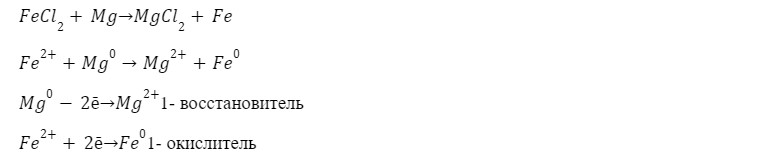
Магнит притягивает частица железа.
Вариант 2
Химические свойства хлорида меди (II)
1. Реакция с кислотой
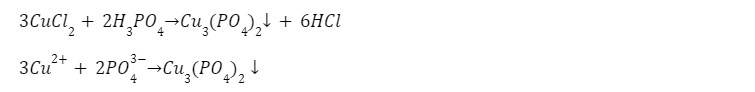
выпадает осадок фосфата меди (II) голубого цвета.
2. Реакция с щелочью

Полученный осадок гидроксида меди (II)- темно-голубого цвета, нерастворим в воде, образует суспензию.
3. Реакция с солью
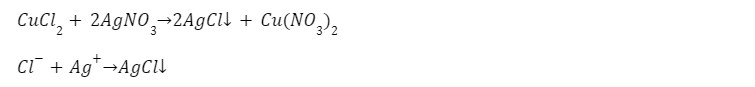
Выпадает белый осадок нерастворимого хлорида серебра.
4. Реакция с металлом
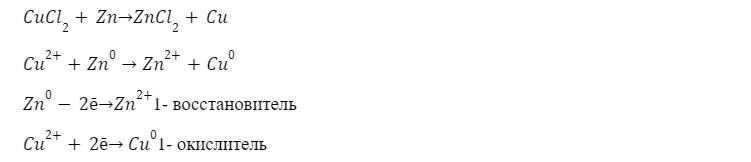
5. Реакция восстановления до хлорида меди (I) с медью
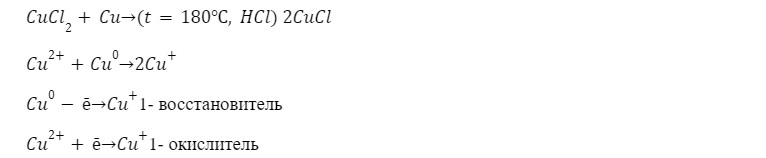
Раствор обесцветился, образовался комплекс осадка нерастворимого хлорида меди (I) и меди.
